Q6. 品質管理の基準は?
ジェネリック医薬品メーカーは、先発医薬品メーカーと比べて1社あたりの製造販売品目が多いので、各品目に対する品質管理が不十分になるのではないか。
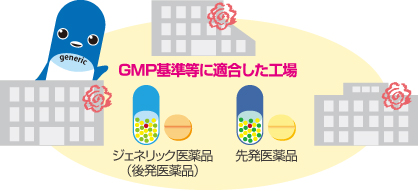
医薬品が製造販売承認を得るためには、その製造所での製造がGMP(医薬品及び医薬部外品の製造管理及び品質管理に関する基準)(※8)に適合していなければなりません。先発医薬品メーカー、ジェネリック医薬品メーカーを問わず、全ての医薬品は、共通のGMP等の基準を満たした製造所でのみ製造が許されていることになります。
GMP等の基準の遵守状況についても、各都道府県に配置された薬事監視員等による定期的な査察により、チェックがなされています。
また、製造された医薬品製剤のサンプルは保存され、出荷後、定期的に品質の変化をチェックすることも行われています。さらに、都道府県等の協力のもと実施している医薬品等一斉監視指導において、実際に市場に流通しているジェネリック医薬品を入手し、溶出試験等の品質検査により重点的にチェックを行い、その結果を年度ごとに取りまとめて公表しています(※9)。

なお、現行の法律では、医薬品の承認を取得した製造販売業者が別の業者に製造を委託することが可能です。先発医薬品であっても、製造委託により、実際にはジェネリック医薬品メーカーの工場で製造が行われることもあります。
もちろん、GMP等はあくまでも医薬品を製造管理・品質管理するための「基準」であり、当然のことながら、全ての医薬品メーカーが高いモラルを持って絶えず品質管理の努力とスキル向上を徹底することが重要になります(※10)。
(※8)
医薬品及び医薬部外品の品質確保を図るため、原料の受入れから最終製品の包装、出荷に至るまで、全製造工程における組織的な管理に基づく品質保証体制を確立するために定められた基準をいいます。
(※9)
「後発医薬品品質確保対策事業」(医薬食品局監視指導・麻薬対策課)として実施しており、年度ごとの検査結果報告書についても厚生労働省ホームページよりご覧になることができます。(平成24年度検査結果)
http://www.mhlw.go.jp/stf/houdou/0000016052.html![]()
(※10)
先発医薬品メーカー、ジェネリック医薬品メーカーを問わず、モラルの欠知によって医薬品メーカーが法律違反を犯した事例が存在するのも事実です。こうした不祥事には、業務停止等の罰則や厳格な業務改善命令が科せられることになります。
「ジェネリック医薬品への疑問に答えます ~ジェネリック医薬品Q&A~(厚生労働省:平成27年2月版)![]() 」をもとにニプロESファーマ株式会社作成
」をもとにニプロESファーマ株式会社作成
当サイトに含まれている文書・写真・イラスト等の利用については、ご利用規約をご覧ください。